Экстрагирование
Экстра́кция (от лат. extraho — извлекаю ) — это извлечение вещества из раствора или сухой смеси с помощью растворителя (экстраге́нта), практически не смешивающегося с исходной смесью.
Экстракция может быть разовой (однократной или многократной) или непрерывной (перколя́ция).
Простейший способ экстракции из раствора — однократная или многократная промывка экстрагентом в делительной воронке. Делительная воронка представляет собой сосуд с пробкой и краном для слива нижнего слоя жидкости. Для непрерывной экстракции используются специальные аппараты — экстракторы, или перколяторы.
Для извлечения индивидуального вещества или определённой смеси (экстракта) из сухих продуктов в лабораториях широко применяется непрерывная экстракция по Сокслету.
В лабораторной практике химического синтеза экстракция может применяться для выделения чистого вещества из реакционной смеси или для непрерывного удаления одного из продуктов реакции из реакционной смеси в ходе синтеза.
Экстракция применяется в химической, нефтеперерабатывающей, пищевой, металлургической, фармацевтической и других отраслях, в аналитической химии и химическом синтезе.
экстраги́рование
1. спец. действие по значению гл. экстрагировать; извлечение одного или нескольких компонентов из твёрдого тела в жидкую фазу с помощью избирательного растворителя (экстрагента)
2. перен. извлечение, выделение чего-либо важного откуда-либо
Экстракция веществ из растворов
Простейший вид экстракции — встряхивание раствора вещества в определенном растворителе с другим растворителем, не смешивающимся с первым. Растворитель, служащий экстрагентом, должен лучше растворять экстрагируемое вещество, чем растворитель, из которого это вещество извлекается.
Для экстракции органических веществ из водных растворов пользуются делительной воронкой, в которой смешивают водный раствор вещества (около 1/2 объема воронки) с экстрагентом (1/5 — 1/3 объема воронки). Воронку закрывают пробкой и энергично взбалтывают в течение нескольких секунд, придерживая верхнюю пробку одной рукой, а кран на спускной трубке — другой. Затем делительную воронку переворачивают краном вверх и, осторожно открывая кран, выпускают образующиеся пары.
Если экстрагентом служит диэтиловый эфир, давление паров которого при комнатной температуре довольно велико, в делительной воронке создается значительное избыточное давление. После выравнивания давления кран делительной воронки закрывают, встряхивание и периодическое выпускание паров продолжают до тех пор, пока газовое пространство над жидкостью в делительной воронке не будет заполнено парами растворителя и давление не перестанет меняться. Тогда приступают к более продолжительному и энергичному встряхиванию. По окончании встряхивания делительную воронку укрепляют в штативе, приоткрывают пробку и дают жидкости полностью разделиться на два слоя, которые должны быть совершенно прозрачны. Далее открывают кран и спускают водный слой (если плотность экстрагента меньше плотности воды) в приемную емкость. Слой органической жидкости через верхнее отверстие делительной воронки выливают в колбу с притертой пробкой.
Водный раствор снова переносят в делительную воронку, добавляют новую порцию растворителя и повторяют процесс несколько раз.
Для того чтобы определить, закончен ли процесс экстракции, небольшое количество последней порции экстракта выпаривают на часовом стекле и высушивают в вакуум-эксикаторе над Mg(ClO4)2.
Полученные вытяжки собирают в одну колбу и сушат с помощью соответствующего осушающего средства. После сушки вытяжку фильтруют, затем удаляют растворитель (отгонкой, выпариванием в вакууме), а остаток очищают путем кристаллизации, сублимации или перегонки.
Часто, особенно при экстракции водных щелочных растворов, образуются эмульсии, которые с большим трудом разделяются на два слоя. В этих случаях разделение слоев может быть достигнуто одним из следующих приемов: 1) через жидкость в делительной воронке продувают ток воздуха; 2) водный слой насыщают NaCl; 3) добавляют несколько капель поверхностно-активного вещества, понижающего поверхностное натяжение (например, октилового спирта).
Если вещество значительно лучше растворяется в воде, чем в органическом растворителе, экстракция путем взбалтывания в делительной воронке не дает хороших результатов, и тогда приходится применять непрерывную экстракцию.
Химическое разделение веществ
Из раствора смеси веществ в органическом растворителе можно выделить компоненты, используя различие их химических свойств. Это достигается встряхиванием раствора в делительной воронке с водным раствором кислоты, если нужно отделить вещество основного характера (амины, аминокислоты, аминоспирты), либо водным раствором Na2CO3 или NaHCO3, если нужно отделить вещество кислотного характера. Эту операцию выполняют так же, как и обычную экстракцию, хотя она основана не на различной растворимости вещества в разных растворителях, а на его химических свойствах.
Непрерывная экстракция растворов
С помощью экстракторов непрерывного действия — перколяторов — можно извлекать вещество из раствора небольшим количеством растворителя. Растворитель при этом испаряют в колбе, а пары его конденсируют в обратном холодильнике. Конденсат в виде мелких капель, проходя через раствор, постепенно обогащается извлекаемым веществом и стекает через перелив обратно в колбу. Перколяторы, в зависимости от того, легче или тяжелее растворитель экстрагируемого раствора, различаются конструктивно.
На рис. 173, а изображен простейший прибор, применяемый для экстракции жидкости более легким растворителем. Растворитель нагревают в колбе 1. Пары растворителя через трубку 2 попадают в обратный холодильник, и конденсат стекает в воронку 3; через трубку воронки растворитель попадает в нижнюю часть пробирки 4 и, поднимаясь на поверхность раствора, извлекает растворенное в нем вещество. Экстракт через боковую трубку стекает в колбу 1.
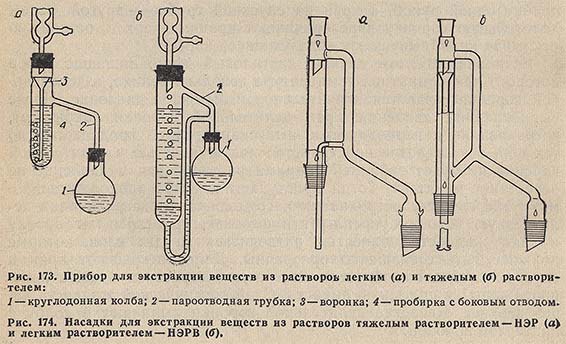
Прибор для экстракции из растворов тяжелым растворителем изображен на рис. 173,6.
Насадки для непрерывного экстрагирования веществ из растворов выпускаются двух типов (рис. 174): НЭР — для экстрагирования тяжелым растворителем; НЭРВ — для экстрагирования легким растворителем.
Содержание

Принцип [ править | править код ]
Жидкостная экстракция — процесс перехода одного или нескольких растворенных веществ из одной жидкой фазы в другую (экстрагент), практически нерастворимую или частично растворимую в первой, но растворяющую эти вещества. Исходный водный раствор, содержащий растворенное в нем распределяемое вещество, непосредственно контактирует с экстрагентом. В результате взаимодействия образуются две фазы: экстракт — отделенная органическая фаза, обогащенная распределяемым веществом, и рафинат — водная фаза, практически не содержащая распределяемого вещества.
Экстрагент, как правило, представляет собой раствор реагента в разбавителе. Реагент — это вещество, взаимодействующее с распределяемым веществом и определяющее процесс экстракции. Разбавитель — инертный органический растворитель, который улучшает физические или экстракционные свойства экстрагента. В ряде случаев используется экстракция инертными растворителями, например, в случае извлечения координационно несольватированных соединений.
Классификация экстракционных процессов [ править | править код ]
Существует несколько подходов к классификации методов жидкостной экстракции, основанные как на способе осуществления процесса, так и на типе используемого экстрагента.
Классификация Л. М. Гиндина [ править | править код ]
- Экстракция по механизму физического распределения, при этом не происходит изменения состава извлекаемого соединения.
- Катионообменная экстракция. Используются кислотные экстрагенты, например, карбоновые кислоты, ионы металлов извлекаются в виде катионов, например амминокомплексов или аквакомплексов.
- Анионообменная экстракция. Используются основные экстрагенты, например, соли четвертичных аммонийных оснований, ионы металлов извлекаются в виде анионов.
- Координационная экстракция. Экстракция ионов металлов осуществляется в форме внутрикомплексных соединений.
- Экстракция гетерополисоединений.
Классификация А. Н. Розена [ править | править код ]
Классификация основана на характере диссоциации экстрагируемого вещества в водной и органической фазах:
- Электролит в водной фазе — неэлектролит в органической фазе.
- Электролит в водной фазе — электролит в органической фазе. В этом случае органическая фаза должна обладать высокой диэлектрической проницаемостью.
- Неэлектролит в водной фазе — неэлектролит в органической фазе.
Классификация Ю. А. Золотова и Н. М. Кузьмина [ править | править код ]
1. Экстракция неионизированных соединений:
- Экстракция координационно несольватированных молекулярных галогенидов (I2, SnI4, SeBr4) инертными растворителями (бензол, четыреххлористый углерод).
- Экстракция внутрикомплексных соединений (хелатов) кислотными экстрагентами.
- Экстракция координационно сольватированных нейтральных комплексов. Экстрагент в этом случае входит в состав извлекаемого соединения.
2. Экстракция ионизированных соединений:
- Экстракция комплексных металлокислот (например H[FeCl4]).
- Экстракция координационно несольватированных солей с объемными катионами и анионами.
- Экстракция сильных кислот.
- Экстракция гетерополисоединений.
Применение жидкостной экстракции [ править | править код ]
В аналитической химии жидкостная экстракция используется для концентрирования микропримесей и выделения органических и неорганических веществ с целью их дальнейшего количественного определения различными методами (спектрофтометрическими, хроматографическими, и другими). Широкое распространение жидкостная экстракция получила в экологических исследованиях и в лабораторном контроле качества различной продукции.
В промышленности жидкостная экстракция используется как метод выделения целевых продуктов органического синтеза из реакционной массы, а также при получении цветных и редкоземельных металлов из природного сырья.
Жидкостная экстракция является также методом научных исследований. Применяется для исследования состава, устойчивости и других характеристик комплексных соединений ионов металлов в растворах.
Уравнение Нернста [ править | править код ]
Экстракция базируется на законе разделения: изъятие вещества из раствора тем полнее, чем больше коэффициент его распределения отличается от единицы.
Используемые технологии
Растительные экстракты получают с помощью технологий:
- Перколяция. Сырье настаивают на выбранном экстрагенте. Выделение действующего вещества происходит в 2 этапа — в первичной порции 85%, во вторичной порции — 15%. После этого сырье уже полностью истощено.
- Реперколяция. Выделение ценных веществ происходит в перколятах, которые соединены между собой последовательно. Процесс идет беспрерывно без упаривания, что дает возможность извлечь действующее вещество в максимальном количестве.
Существует несколько видов реперколяции и перколяции. Применяют реперколяцию, при которой сырье делится на одинаковые части с законченным или незаконченным циклом. Применяются методы Чулкова, Босина и другие.
Каждому конкретному растению подбирают свой растворитель, который подействует максимально эффективно. Процедура происходит обычно при комнатной температуре, до 20°C. Сырье предварительно нарезают и измельчают. Запах и вкус растений существенно влияют на качество полученного готового продукта.
Содержание

Принцип
Жидкостная экстракция — процесс перехода одного или нескольких растворенных веществ из одной жидкой фазы в другую (экстрагент), практически нерастворимую или частично растворимую в первой, но растворяющую эти вещества. Исходный водный раствор, содержащий растворенное в нем распределяемое вещество, непосредственно контактирует с экстрагентом. В результате взаимодействия образуются две фазы: экстракт — отделенная органическая фаза, обогащенная распределяемым веществом, и рафинат — водная фаза, практически не содержащая распределяемого вещества.
Экстрагент, как правило, представляет собой раствор реагента в разбавителе. Реагент — это вещество, взаимодействующее с распределяемым веществом и определяющее процесс экстракции. Разбавитель — инертный органический растворитель, который улучшает физические или экстракционные свойства экстрагента. В ряде случаев используется экстракция инертными растворителями, например, в случае извлечения координационно несольватированных соединений.
Классификация экстракционных процессов
Существует несколько подходов к классификации методов жидкостной экстракции, основанные как на способе осуществления процесса, так и на типе используемого экстрагента.
Классификация Л. М. Гиндина
- Экстракция по механизму физического распределения, при этом не происходит изменения состава извлекаемого соединения.
- Катионообменная экстракция. Используются кислотные экстрагенты, например, карбоновые кислоты, ионы металлов извлекаются в виде катионов, например амминокомплексов или аквакомплексов.
- Анионообменная экстракция. Используются основные экстрагенты, например, соли четвертичных аммонийных оснований, ионы металлов извлекаются в виде анионов.
- Координационная экстракция. Экстракция ионов металлов осуществляется в форме внутрикомплексных соединений.
- Экстракция гетерополисоединений.
Классификация А. Н. Розена
Классификация основана на характере диссоциации экстрагируемого вещества в водной и органической фазах:
- Электролит в водной фазе — неэлектролит в органической фазе.
- Электролит в водной фазе — электролит в органической фазе. В этом случае органическая фаза должна обладать высокой диэлектрической проницаемостью.
- Неэлектролит в водной фазе — неэлектролит в органической фазе.
Классификация Ю. А. Золотова и Н. М. Кузьмина
1. Экстракция неионизированных соединений:
- Экстракция координационно несольватированных молекулярных галогенидов (I2, SnI4, SeBr4) инертными растворителями (бензол, четыреххлористый углерод).
- Экстракция внутрикомплексных соединений (хелатов) кислотными экстрагентами.
- Экстракция координационно сольватированных нейтральных комплексов. Экстрагент в этом случае входит в состав извлекаемого соединения.
2. Экстракция ионизированных соединений:
- Экстракция комплексных металлокислот (например H[FeCl4]).
- Экстракция координационно несольватированных солей с объемными катионами и анионами.
- Экстракция сильных кислот.
- Экстракция гетерополисоединений.
Применение жидкостной экстракции
В аналитической химии жидкостная экстракция используется для концентрирования микропримесей и выделения органических и неорганических веществ с целью их дальнейшего количественного определения различными методами (спектрофтометрическими, хроматографическими, и другими). Широкое распространение жидкостная экстракция получила в экологических исследованиях и в лабораторном контроле качества различной продукции.
В промышленности жидкостная экстракция используется как метод выделения целевых продуктов органического синтеза из реакционной массы, а также при получении цветных и редкоземельных металлов из природного сырья.
Жидкостная экстракция является также методом научных исследований. Применяется для исследования состава, устойчивости и других характеристик комплексных соединений ионов металлов в растворах.
Уравнение Нернста
Экстракция базируется на законе разделения: изъятие вещества из раствора тем полнее, чем больше коэффициент его распределения отличается от единицы.
Содержание

Принцип [ | ]
Жидкостная экстракция — процесс перехода одного или нескольких растворенных веществ из одной жидкой фазы в другую (экстрагент), практически нерастворимую или частично растворимую в первой, но растворяющую эти вещества. Исходный водный раствор, содержащий растворенное в нем распределяемое вещество, непосредственно контактирует с экстрагентом. В результате взаимодействия образуются две фазы: экстракт — отделенная органическая фаза, обогащенная распределяемым веществом, и рафинат — водная фаза, практически не содержащая распределяемого вещества.
Экстрагент, как правило, представляет собой раствор реагента в разбавителе. Реагент — это вещество, взаимодействующее с распределяемым веществом и определяющее процесс экстракции. Разбавитель — инертный органический растворитель, который улучшает физические или экстракционные свойства экстрагента. В ряде случаев используется экстракция инертными растворителями, например, в случае извлечения координационно несольватированных соединений.
Классификация экстракционных процессов [ | ]
Существует несколько подходов к классификации методов жидкостной экстракции, основанные как на способе осуществления процесса, так и на типе используемого экстрагента.
Классификация Л. М. Гиндина [ | ]
- Экстракция по механизму физического распределения, при этом не происходит изменения состава извлекаемого соединения.
- Катионообменная экстракция. Используются кислотные экстрагенты, например, карбоновые кислоты, ионы металлов извлекаются в виде катионов, например амминокомплексов или аквакомплексов.
- Анионообменная экстракция. Используются основные экстрагенты, например, соли четвертичных аммонийных оснований, ионы металлов извлекаются в виде анионов.
- Координационная экстракция. Экстракция ионов металлов осуществляется в форме внутрикомплексных соединений.
- Экстракция гетерополисоединений.
Классификация А. Н. Розена [ | ]
Классификация основана на характере диссоциации экстрагируемого вещества в водной и органической фазах:
- Электролит в водной фазе — неэлектролит в органической фазе.
- Электролит в водной фазе — электролит в органической фазе. В этом случае органическая фаза должна обладать высокой диэлектрической проницаемостью.
- Неэлектролит в водной фазе — неэлектролит в органической фазе.
Классификация Ю. А. Золотова и Н. М. Кузьмина [ | ]
1. Экстракция неионизированных соединений:
- Экстракция координационно несольватированных молекулярных галогенидов (I2, SnI4, SeBr4) инертными растворителями (бензол, четыреххлористый углерод).
- Экстракция внутрикомплексных соединений (хелатов) кислотными экстрагентами.
- Экстракция координационно сольватированных нейтральных комплексов. Экстрагент в этом случае входит в состав извлекаемого соединения.
2. Экстракция ионизированных соединений:
- Экстракция комплексных металлокислот (например H[FeCl4]).
- Экстракция координационно несольватированных солей с объемными катионами и анионами.
- Экстракция сильных кислот.
- Экстракция гетерополисоединений.
Применение жидкостной экстракции [ | ]
В аналитической химии жидкостная экстракция используется для концентрирования микропримесей и выделения органических и неорганических веществ с целью их дальнейшего количественного определения различными методами (спектрофтометрическими, хроматографическими, и другими). Широкое распространение жидкостная экстракция получила в экологических исследованиях и в лабораторном контроле качества различной продукции.
В промышленности жидкостная экстракция используется как метод выделения целевых продуктов органического синтеза из реакционной массы, а также при получении цветных и редкоземельных металлов из природного сырья.
Жидкостная экстракция является также методом научных исследований. Применяется для исследования состава, устойчивости и других характеристик комплексных соединений ионов металлов в растворах.
Уравнение Нернста [ | ]
Экстракция базируется на законе разделения: изъятие вещества из раствора тем полнее, чем больше коэффициент его распределения отличается от единицы.
Технология сверхкритической СО2 экстракции растительного сырья:
При давлении свыше 7,39 МПа и температуре более 31,6ºС диоксид углерода находится в так называемом сверхкритическом состоянии, при котором его плотность как у жидкости, а вязкость и поверхностное натяжение как у газа. Эта необычная физическая субстанция (флюид) является отличным неполярным растворителем. Сверхкритический CO2 способен полностью или выборочно экстрагировать любые неполярные составляющие, а при введении сорастворителя способен растворять и полярные вещества находящиеся в растительном сырье.
Углекислый газ (или диоксид углерода ), применяемый в сверхкритическом состоянии для экстракции натурального сырья (растительного или животного) обладает всеми преимуществами и возможностями сжатого газа. Более того, он обладает целым рядом привлекательных свойств, обеспечивающих дополнительные преимущества при использовании этого газа в качестве вспомогательного средства при экстракции.
CO2 обладает универсальной растворяющей способностью по отношению к органическим соединениям, физиологически не вызывает опасений, т.к. является конечным продуктом метаболизма ряда живых организмов, в том числе и человека.
CO2 является стерильным и бактериостатичным соединением, CO2 не горит и не является взрывчатым веществом, что немаловажно для производственных условий.
CO2 безопасен для окружающей среды, что позволяет говорить о возможности создания экологически чистого вида производства.
CO2 сравнительно легок в получении, а, значит, является достаточно дешевым видом растворителя.
Технология сверхкритической СО2 экстракции является высокорентабельной и самой энергосберегающей технологией экстракции растительного сырья из известных технологий.
СО2 экстракция растительного сырья позволяет производить переработку не только высококачественного сырья, но и отходов производства с целью экстрагирования из них основных компонентов для придания более высокого качества низким сортам продукта.
Примечание: © Фото https://www.pexels.com, https://pixabay.com. Видео https://youtu.be/fdtxDvXozCo.
расчеты показателей способы методы ультразвуковой датчик для экстракции растительного сырья
водная экстракция растительного сырья автореферат статья
экстракция углекислым газом из растительного сырья
экстракция растительного сырья углекислым газом вакуум метод воды вещества масла жидкостная вакуумная растворов водная твердофазная кофе определение система металлов кислот сверхкритическая применение установка технология спиртами способы виды ледяная режим время суть схема продукт днк степень












